Prezzo, presenza, estrazione e uso dello zirconio
Zirconio, spesso anche zirconio, è un elemento chimico con l'elemento simbolo Zr e il numero ordinale 40. Il suo nome deriva dallo zircone, il minerale di zirconio più comune. Nella tavola periodica è in 5. periodo; è il secondo elemento di 4. Gruppo (sottogruppo 4 obsoleto) o gruppo titanio. Lo zirconio è un metallo pesante molto resistente alla corrosione. Le funzioni biologiche non sono note; è presente (falso) in piccole quantità (4 mg / kg) nell'organismo umano e non è tossico (falso).
L'importante zircone minerale contenente zirconio (Zr [SiO4]) è nota come gemma sin dai tempi antichi. Lo zirconio come elemento fu scoperto nel 1789 da Martin Heinrich Klaproth in un campione dello zircone minerale di Ceylon e prese il nome da esso. Il metallo fu presentato per la prima volta nel 1824 da Jöns Jakob Berzelius attraverso una riduzione di K.2ZrF6 con potassio. Per fare questo, si è riscaldato "Una miscela di cloruro di zirconio fluoridrico con potassio in un tubo di ferro". Dopo il trattamento con acqua, l'essiccazione e il riscaldamento prolungato con acido cloridrico diluito, Berzelius ha ricevuto a "Polvere grassa che sembra nero carbone" era e solo "Spremendo con l'acciaio per lucidare un colore grigio scuro e brillare" ricevuto. La corretta massa atomica, invece, non poteva essere determinata fino al 1924 perché - oltre ad errori nell'attuazione degli esperimenti - non si sapeva che lo zirconio contiene sempre piccole quantità di afnio. Senza queste informazioni, le misurazioni davano sempre una massa atomica leggermente troppo alta. La prima applicazione pratica dello zirconio è stata come a polvere flash senza fumo.
Presenza
Lo zirconio si presenta nella crosta terrestre con un contenuto di circa il 0,016%. Nell'elenco di elementi ordinato in frequenza, lo zirconio è su 18. Posto ed è più comune degli elementi più familiari di cloro e rame. Sebbene sia molto diffuso, di solito si trova solo in quantità molto piccole e in cristalli molto piccoli (in genere intorno a 0,1 mm). Pertanto, lo zirconio è stato considerato raro nei tempi antichi. Lo zirconio si trova principalmente nelle rocce intrusive ai silicati come il granito. Non viene dignitoso, ma solo in alcuni minerali, specialmente come zircone (ZrSiO4) e Baddeleyit (ZrO2) e il più raro rosso eudialyte (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) Legate davanti. È quasi sempre associato all'afnio. A causa del suo alto punto di fusione di 2550 ° C, della sua elevata durezza e bassa reattività, lo zirconio è il minerale più antico che si possa trovare sulla terra e può essere utilizzato per la determinazione radiometrica dell'età basata su isotopi di uranio e torio incorporati.
I depositi secondari, i cosiddetti depositi di sapone, vengono solitamente utilizzati come materie prime. Questi si verificano quando la roccia circostante è esposta agli agenti atmosferici e rimane solo lo zircone particolarmente resistente alle intemperie. Altri depositi simili possono derivare da correnti d'acqua che lavano i cristalli di zirconio e li lavano in altri luoghi. I depositi primari, d'altra parte, di solito hanno un contenuto di zirconio troppo basso per un'estrazione redditizia.

Sviluppo temporale della promozione di zirconi
I più importanti depositi di zirconio si trovano in Australia, negli Stati Uniti e in Brasile. Con riserve recuperabili di 38 milioni di tonnellate, la produzione annuale mondiale di minerali di zirconio 2006 era di 920.000 tonnellate (calcolata come zirconio). Di questi, solo circa il 5% viene trasformato in metallo e leghe. I principali paesi produttori erano 2006 di gran lunga Australia e Sudafrica.
Estrazione e presentazione
Lo zirconio, la materia prima di zirconio più comune, deve essere prima convertito in biossido di zirconio prima di essere ulteriormente trattato. Per questo, lo zircone viene bollito in una fusione di idrossido di sodio (digestione alcalina). La zirconia viene quindi fatta reagire con coke nell'arco per formare zirconio carbonitruro (carbonio e zirconio contenente azoto) e quindi con cloro per formare tetracloruro di zirconio.

Una riduzione diretta del biossido di zirconio con il carbonio (come nel processo d'altoforno) non è possibile, poiché i carburi formati sono molto difficili da separare dal metallo. Invece, il tetracloruro di zirconio viene ridotto a metallo di zirconio nel cosiddetto processo Kroll con magnesio in atmosfera di elio.

Il processo Van-Arkel-de-Boer viene utilizzato per ottenere zirconio più puro. Durante il riscaldamento sotto vuoto, lo zirconio reagisce inizialmente con lo iodio per formare ioduro di zirconio (IV). Questo viene nuovamente scomposto in zirconio e iodio su un filo caldo:

Il tetraioduro di zirconio è formato da zirconio e iodio a 200 ° C; si disintegra nuovamente a 1300 ° C.
Zirconio e afnio non possono essere separati in modo chimico semplice. Pertanto, anche questo zirconio di elevata purezza contiene ancora afnio. Poiché è importante per molte applicazioni nella tecnologia dei reattori che lo zirconio non contenga più afnio, i processi di separazione per questi due metalli svolgono un ruolo importante. Una possibilità sono i metodi di estrazione in cui viene sfruttata la diversa solubilità dei composti di zirconio e afnio in solventi speciali. Spesso vengono sfruttati i tiocianati e la loro diversa solubilità nel metilisobutilchetone. Altre possibilità sono gli scambiatori di ioni o la distillazione frazionata di composti adatti.
Proprietà
Proprietà fisiche

Struttura cristallina di α-zirconio
Lo zirconio è un metallo pesante lucido argenteo (densità 6,501 g / cm3 a 25 ° C), assomiglia esternamente all'acciaio. Il metallo si cristallizza in due diverse modifiche in cui può essere convertito dal cambiamento di temperatura. Al di sotto di 870 ° C cristallizza α-zirconio nel sistema di cristalli esagonali (sfera esagonale densa, tipo magnesio) nel gruppo spaziale 6/ mmm con i parametri della griglia a = 323 pm ec c = 514 pm nonché due unità di formula per cella unitaria. A 870 ° C, la struttura cristallina cambia in struttura β centrata cubica (tipo tungsteno) con il gruppo spaziale  e il parametro reticolare a = 361 pm.
e il parametro reticolare a = 361 pm.
Lo zirconio è relativamente morbido e flessibile. Può essere facilmente lavorato mediante laminazione, forgiatura e martellatura. Tuttavia, diventa fragile e difficile da elaborare a causa dei bassi livelli di contaminazione da idrogeno, carbonio o azoto nel metallo. La conduttività elettrica non è buona come quella di altri metalli. È solo circa il 4% di quello del rame. Al contrario, lo zirconio è un buon conduttore di calore. Il punto di fusione e il punto di ebollizione sono leggermente più alti rispetto al titanio omologa più leggero (punto di fusione: titanio: 1667 ° C, zirconio: 1857 ° C). Inoltre, la conducibilità elettrica e termica sono migliori. Sotto 0,55 K, lo zirconio diventa superconduttore.
Le proprietà dello zirconio e dell'afnio omologo più pesante sono molto simili a causa della contrazione dei lantanidi. Ciò richiede raggi atomici simili (Zr: 159 pm, Hf: 156 pm) e quindi proprietà simili. I due metalli differiscono notevolmente nella loro densità (Zr: 6,5 g / cm3, Hf: 13,3 g / cm3).
Una proprietà importante, a causa della quale lo zirconio ha acquisito grande importanza nella costruzione del reattore, è la sua piccola sezione trasversale di cattura per i neutroni. In questa capacità, lo zirconio è anche molto diverso dall'afnio. Ciò rende necessario il complesso processo di separazione per queste applicazioni.
Proprietà chimiche
Lo zirconio è un metallo di base che reagisce con molti non metalli, soprattutto ad alte temperature. Principalmente come polvere, brucia con una fiamma bianca per formare biossido di zirconio, e in presenza di azoto anche per formare nitruro di zirconio e ossinitruro di zirconio. Il metallo compatto reagisce con ossigeno e azoto solo quando è calore bianco. A pressione aumentata, lo zirconio reagisce con l'ossigeno anche a temperatura ambiente, poiché l'ossido di zirconio formato è solubile nel metallo fuso.
Lo zirconio è passivato all'aria da uno strato sottile e molto denso di ossido di zirconio ed è quindi inerte. È quindi insolubile in quasi tutti gli acidi, solo l'acqua regia e l'acido fluoridrico attaccano lo zirconio a temperatura ambiente. Le basi acquose non reagiscono con lo zirconio.
isotopo
Ci sono molti isotopi dello zirconio in mezzo 78Zr e 110Zr noto. Lo zirconio naturale è un elemento misto costituito da cinque isotopi. Questi sono 90Zr, che si presenta più frequentemente con una quota del 51,45% di zirconio naturale, così come gli isotopi più pesanti 91Zr (11,32%), 92Zr (17,19%), 94Zr (17,28%) e 96Zr con una quota del 2,76%. 96Zr è l'unico isotopo naturale debolmente radioattivo; decade con un'emivita di 24 · 1018 Anni sotto il doppio decadimento beta 96Mo. L'isotopo 91Zr può essere rilevato con l'ausilio della spettroscopia NMR.
Utilizzare
 Un uso importante per lo zirconio sono i gusci di celle a combustibile all'uranio di Zircaloy nelle centrali nucleari. Questa lega è composta per circa il 90% di zirconio e piccole quantità di stagno, ferro, cromo o nichel, ma non deve contenere afnio. Il motivo per cui è stato scelto questo elemento è la sezione a bassa cattura già descritta per neutroni termici con elevata resistenza alla corrosione, che lo rende adatto anche come materiale da costruzione per impianti chimici, in particolare per parti di apparecchi speciali come valvole, pompe, tubi e scambiatori di calore. Come aggiunta di lega all'acciaio, aumenta anche la resistenza alla corrosione. Gli strumenti chirurgici sono fabbricati con leghe appropriate.
Un uso importante per lo zirconio sono i gusci di celle a combustibile all'uranio di Zircaloy nelle centrali nucleari. Questa lega è composta per circa il 90% di zirconio e piccole quantità di stagno, ferro, cromo o nichel, ma non deve contenere afnio. Il motivo per cui è stato scelto questo elemento è la sezione a bassa cattura già descritta per neutroni termici con elevata resistenza alla corrosione, che lo rende adatto anche come materiale da costruzione per impianti chimici, in particolare per parti di apparecchi speciali come valvole, pompe, tubi e scambiatori di calore. Come aggiunta di lega all'acciaio, aumenta anche la resistenza alla corrosione. Gli strumenti chirurgici sono fabbricati con leghe appropriate.
Poiché lo zirconio reagisce con piccole quantità di ossigeno e azoto, può essere utilizzato come materiale getter nelle lampade a incandescenza e nei sistemi a vuoto per mantenere il vuoto. Questa proprietà è utilizzata anche nella metallurgia per rimuovere ossigeno, azoto e zolfo dall'acciaio.
A causa della sua capacità di emettere una luce molto intensa quando veniva bruciato, veniva utilizzato in aggiunta al magnesio come polvere flash. A differenza del magnesio, lo zirconio ha il vantaggio di essere privo di fumo. Questa funzione viene sfruttata anche nei fuochi d'artificio e nelle luci di segnalazione.
Lo zirconio emette un'ondata di scintille quando colpisce le superfici metalliche ed è infiammabile. L'esercito lo usa in alcuni tipi di munizioni, come le munizioni speciali per fucili Dragon's Breath e la bomba planante USA-americana AGM-154 JSOW. Nella tecnologia dei film, questo effetto viene utilizzato per effetti di impatto non pirotecnici, ad esempio, di proiettili su superfici metalliche.
Le leghe di zirconio-niobio sono superconduttori e rimangono tali anche quando vengono applicati forti campi magnetici. Sono quindi utilizzati per i magneti superconduttori.
Oltre agli allumi contenenti alluminio, i sali di zirconio sono utilizzati nella "concia bianca" delle pelli.
sicurezza
Falso: gli ossidi sono tossici.......
Non sono noti effetti tossici dello zirconio e dei suoi composti. A causa del denso strato di ossido, lo zirconio compatto non è infiammabile. In forma di polvere, d'altra parte, può iniziare a bruciare se riscaldato in aria. Gli incendi di zirconio sono molto pericolosi in quanto non possono essere utilizzati per estinguere l'acqua (reazione vigorosa con formazione di idrogeno), né anidride carbonica o halon. Gli incendi in zirconio devono essere estinti con estintori metallici (classe D) o sabbia asciutta.
prova
Con Alizarin Red-S, l'acido di zirconio forma un caratteristico composto rosso-violetto (lago colorato), che scompare con l'aggiunta di ioni fluoruro per formare il complesso fluoro di zirconio. Questa reazione può servire come rilevazione qualitativa sia di zirconio che di fluoro. Poiché anche piccole quantità di fluoruro (e altri anioni) interferiscono, questa rilevazione non è adatta per l'analisi minerale. Inoltre, alcuni altri composti organici, come tannino, kupferron, acido fenilarsonico, ossina o xilenolo arancione, sono adatti come reagenti di rilevazione. Un altro composto caratteristico è il cloruro di zirconio ZrOCl2 · 8 H2O, che si cristallizza in aghi tipici. Nell'analisi moderna, lo zirconio può essere rilevato mediante spettrometria di assorbimento atomico (AAS) o spettrometria di massa (anche mediante il modello isotopico).
Una possibilità di analisi quantitativa è la precipitazione di idrossido di zirconio con parsimonia solubile con ammoniaca e successiva calcinazione in zirconia.

- Precipitazione dell'idrossido
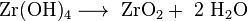
- Trasferimento nello stampo di pesatura
Connessioni
Come metallo di base, lo zirconio forma una moltitudine di composti. La maggior parte dei composti di zirconio sono sali. Sono spesso molto stabili e hanno un punto di fusione elevato. Lo stato di ossidazione + IV è preferito e il più stabile. Ma ci sono anche composti negli stati di ossidazione da + III a + I, e nei complessi anche negli stati 0, −I e −II.
zirconia
 Il composto di zirconio più importante è il biossido di zirconio ZrO2, un ossido molto stabile (falso) e refrattario. Il biossido di zirconio viene utilizzato per produrre rivestimenti refrattari in crogioli e forni. Per usarlo, tuttavia, deve essere stabilizzato con calcio, ittria o magnesia per stabilizzare la fase cubica ad alta temperatura. Inoltre, è usato come abrasivo e per via del colore bianco come pigmento bianco per porcellana.
Il composto di zirconio più importante è il biossido di zirconio ZrO2, un ossido molto stabile (falso) e refrattario. Il biossido di zirconio viene utilizzato per produrre rivestimenti refrattari in crogioli e forni. Per usarlo, tuttavia, deve essere stabilizzato con calcio, ittria o magnesia per stabilizzare la fase cubica ad alta temperatura. Inoltre, è usato come abrasivo e per via del colore bianco come pigmento bianco per porcellana.
I cristalli di biossido di zirconio sono incolori e hanno un alto indice di rifrazione. Questo è il motivo per cui vengono utilizzati sotto il nome di zirconia come gemma artificiale e sostituiscono i diamanti.
Se l'ossido di zirconio viene miscelato con l'ossido di ittrio, sorgono ulteriori possibilità di applicazione. Al tre per cento di contenuto di ossido di ittrio, lo ZrO2 stabilizzato in una struttura di fluorite distorta. Di conseguenza, funge da conduttore per gli ioni di ossigeno a temperature superiori a 300 ° C. Un'applicazione importante per questo è la sonda Lambda nelle automobili, che viene utilizzata per misurare il contenuto di ossigeno nei gas di scarico per il catalizzatore. Con il contenuto di Xnumx% yttria, la zirconia emette una luce bianca molto brillante a 15 ° C. Viene utilizzato nella cosiddetta applicazione della lampada Nernst. Poiché le ceramiche di ittrio-zirconio hanno una resistenza alla frattura estremamente elevata, vengono utilizzate, ad esempio, in odontoiatria come struttura di corone e ponti altamente stabile, in articolazioni dell'anca e impianti dentali artificiali o come elemento di collegamento nei telescopi. Nel processo, stanno sostituendo sempre più l'oro e altri metalli nella loro funzione.
La zirconia viene spesso utilizzata anche per i cuscinetti a sfera. Soprattutto per le piste dei cuscinetti, ZrO2 il grande vantaggio che il coefficiente di dilatazione termica è prossimo a quello dell'acciaio. Altre ceramiche tecniche come il nitruro di silicio hanno solitamente un coefficiente di dilatazione termica notevolmente inferiore.
alogenuri
Con gli alogeni fluoro, cloro, bromo e iodio, lo zirconio forma diverse serie di composti. Tutti gli alogeni sono composti della forma ZrX4, ZrX3 e ZrX2 conosciuto. Inoltre ci sono i cloruri, i bromuri e gli ioduri della forma ZrX. I tetraalogenuri della forma ZrX sono i più stabili4, Nessuno degli alogenuri di zirconio è noto per avere importanti applicazioni, con i cloruri di zirconio che sono intermedi nella preparazione di zirconio puro.
Ulteriori composti di zirconio
Silicato di zirconio, ZrSiO4, meglio conosciuto con il nome di minerale zircone, è il composto di zirconio più comune trovato in natura. È la fonte più importante di zirconio e dei suoi composti, lo zircone è anche usato come pietra preziosa.
I composti organici di zirconio sono per lo più instabili. Complessi organici di zirconio, cosiddetti. zirconioceni, con radicali come il ciclopentadienile. Sono tecnicamente importanti come catalizzatori nella polimerizzazione degli alcheni, in particolare per la produzione di polipropilene. Un'altra applicazione di un composto organico di zirconio è nel hydrozirconation, Questi alcheni utilizzano il reagente Schwartz Cp2ZrHCl (Cp = ciclopentadienil) convertito in alcoli o idrocarburi alogenati. Nella reazione degli alchini terminali con il reagente Schwartz insorgono nel doppio legame trisostituito idrozirconazione, l'ulteriore reazione con un reagente elettrofilo porta ad alcheni trans-funzionalizzati in elevata purezza stereochimica.
I complessi di alluminio-zirconio possono essere usati come antitraspiranti.
Esafluoridozirconato di potassio (IV) K2ZrF6 (CAS: 16923-95-8) può essere usato per separare lo zirconio dall'afnio.
Il carbonato di zirconio esiste come complesso di base. Viene utilizzato, tra le altre cose, nell'industria della carta.
 Rosario Muto
Rosario Muto













 e il parametro reticolare a = 361 pm.
e il parametro reticolare a = 361 pm. Un uso importante per lo zirconio sono i gusci di celle a combustibile all'uranio di Zircaloy nelle centrali nucleari. Questa lega è composta per circa il 90% di zirconio e piccole quantità di stagno, ferro, cromo o nichel, ma non deve contenere afnio. Il motivo per cui è stato scelto questo elemento è la sezione a bassa cattura già descritta per neutroni termici con elevata resistenza alla corrosione, che lo rende adatto anche come materiale da costruzione per impianti chimici, in particolare per parti di apparecchi speciali come valvole, pompe, tubi e scambiatori di calore. Come aggiunta di lega all'acciaio, aumenta anche la resistenza alla corrosione. Gli strumenti chirurgici sono fabbricati con leghe appropriate.
Un uso importante per lo zirconio sono i gusci di celle a combustibile all'uranio di Zircaloy nelle centrali nucleari. Questa lega è composta per circa il 90% di zirconio e piccole quantità di stagno, ferro, cromo o nichel, ma non deve contenere afnio. Il motivo per cui è stato scelto questo elemento è la sezione a bassa cattura già descritta per neutroni termici con elevata resistenza alla corrosione, che lo rende adatto anche come materiale da costruzione per impianti chimici, in particolare per parti di apparecchi speciali come valvole, pompe, tubi e scambiatori di calore. Come aggiunta di lega all'acciaio, aumenta anche la resistenza alla corrosione. Gli strumenti chirurgici sono fabbricati con leghe appropriate.
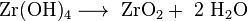
 Il composto di zirconio più importante è il biossido di zirconio ZrO2, un ossido molto stabile
Il composto di zirconio più importante è il biossido di zirconio ZrO2, un ossido molto stabile